Wissenschaftler*innen aus Deutschland, Spanien und den USA sind einer der ältesten Fragen der Biologie nachgegangen: Sie haben untersucht, wie sich Zellen von Meeresschwämmen zu einem vielzelligen Organismus zusammenfügen. Dafür sind große Moleküle, sogenannte Aggregationsfaktoren (AF), verantwortlich – sie wirken wie ein natürlicher Klebstoff zwischen den Zellen. Die Forschenden wollten verstehen, wie AF aufgebaut sind und ob diese mit Verbindungsmechanismen anderer Tiere ähneln. Die Ergebnisse der Studie, an der der Biophysiker Professor Dr. Dario Anselmetti von der Universität Bielefeld beteiligt war, wurden im renommierten Wissenschaftsjournal Proceedings of the National Academy of Sciences (PNAS) veröffentlicht.
Warum sind Schwämme ein gutes Modell, um Zelladhäsion zu erforschen?
Dario Anselmetti: Schwämme im allgemeinen und der Schwamm Clathria prolifera gehören zu den ältesten, fossilen und vielzelligen Lebewesen. Der Übergang von Einzellern zu mehrzelligen Organismen war ein entscheidender Schritt in der Evolution und die Grundlage für unsere eigene Existenz. Eine der offenen Fragen in der Biologie ist, welche Ursachen und Mechanismen diesen Wandel ermöglichten. Dieser Prozess begann vor etwa 500 Millionen Jahren und leitete die „kambrische Explosion des Lebens“, einer Phase rasanter Artenvielfalt, ein.

© Michael Adamski
Sie befassen sich also mit einer der ältesten Fragen der Biologie.
Dario Anselmetti: Genau. Schon 1907 gab das Wilson-Experiment erste Hinweise zur speziesspezifischen Zelladhäsion. Dabei wurden Schwämme verschiedener Farben in Wasser so behandelt, sodass ihre Zellen sich trennten. Als sie sich wieder zusammenlagerten, bildeten die roten Zellen einen roten Schwamm und die gelben Zellen einen gelben. Das war der erste Beweis für die Existenz speziesselektiver Zelladhäsionsmoleküle, was wir Allorekognition nennen.
Sie selbst forschen bereits seit Jahrzehnten dazu. Was dachten Sie früher, wie Zellen aneinanderhaften – und was wissen Sie heute?
Dario Anselmetti: Seit 1994 untersuchen mein Kollege Xavier Fernàndez-Busquets vom Institut für Bioengeneering of Catalonia in Barcelona und ich die molekularen Bindungen zwischen Schwammzellen und den beteiligten AF-Molekülen. Zu diesem Zweck haben wir die isolierten AF-Moleküle auf einen mechanischen Taster eines Rasterkraftmikroskops (AFM) geklebt und mit einem Gegenstück mit dem zweiten Aggregationsfaktor in Kontakt gebracht. Dann haben wir sie auseinandergezogen, um die Bindung zwischen einzelnen molekularen Bindungspartnern zu messen. Damals wussten wir jedoch noch nicht genau, wie die Bindung funktioniert. Klar war, dass der Aggregationsfaktor von Schwämmen eine sonnenstrahlartige Struktur hat – wie ein Ring von dem Strahlen ausgehen. Mit dem speziellen AFM-Mikroskop konnten wir das auch sichtbar machen. Man vermutete, der Ring sitze auf der Zelle und die Strahlen, die wie Tentakeln anmuten, würden sich bei der Adhäsion verbinden. Heute wissen wir: Die Tentakeln liegen an der Oberfläche der Zelle und der ringförmige Teil interagiert an der Oberfläche der Zelle. Dort sitzt ein kleines Zuckermolekül namens g-200, das dafür sorgt, dass sich die Zellen erkennen und verbinden.
Die molekulare Zusammensetzung des Aggregationsfaktors (AF) haben Sie jetzt genauer untersucht. Was haben Sie dabei herausgefunden?
Dario Anselmetti: Unsere Studie hat gezeigt, dass der AF mehr Ähnlichkeit mit anderen tierischen Zellverbindungen hat, als man bisher dachte. Man ging davon aus, dass der AF ein einzigartiges System ist, das es nur bei Schwämmen gibt. Aber unsere Analysen zeigen, dass einige seiner Bestand- und Bauteile starke Ähnlichkeiten mit Proteinen aufweisen, die heute in anderen Tieren Zellverbindungen regulieren, oder andere Prozesse wie die Blutgerinnung oder die Immunerkennung steuern.
Bedeutet das, dass der Mechanismus der Zelladhäsion bei Schwämmen und anderen Tieren eine gemeinsame evolutionäre Grundlage hat?
Dario Anselmetti: Genau das haben wir uns gefragt – ob es in den molekularen Strukturen des Schwammes heute noch Gemeinsamkeiten mit denen von Tieren oder Menschen gibt. Unsere Ergebnisse deuten darauf hin, dass es einen uralten Werkzeugschrank von Protein-Domänen gibt, die schon die ersten mehrzelligen Tiere nutzten, um Zellen miteinander zu verbinden und zwischen „Selbst“ und „Fremd“ zu unterscheiden. Diese Mechanismen haben sich im Laufe der Evolution unterschiedlich weiterentwickelt, aber die Grundprinzipien der Natur scheinen konserviert zu sein.
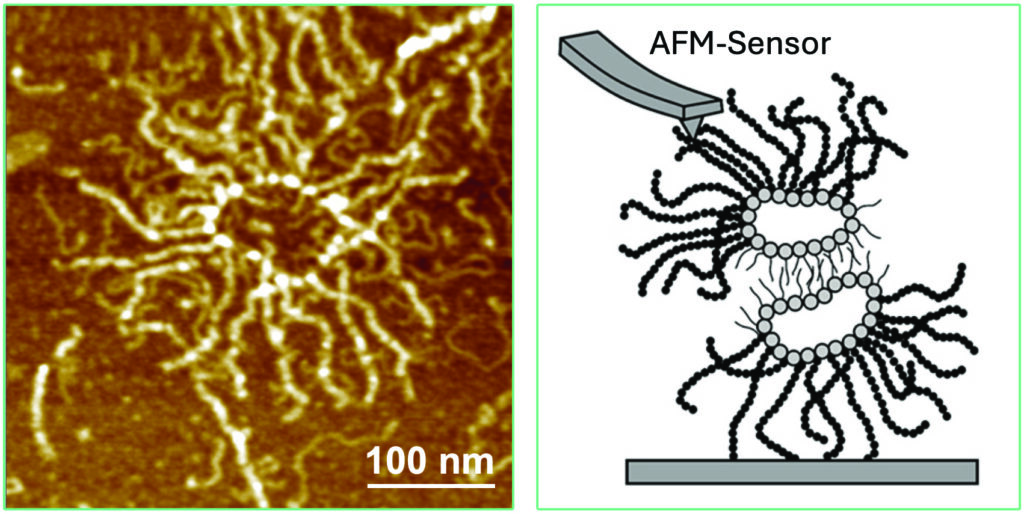
© Dario Anselmetti/Xavier Fernàndez-Busquets
Welche Bedeutung hat dieses Prinzip für Lebewesen?
Dario Anselmetti: Dieses Erkennen von fremd und eigen ist ein zentrales Element des Wachstums. Das geschieht durch viele Milliarden Interaktionen von Molekülen, die zur richtigen Zeit am richtigen Ort ihren Bindungspartner finden. Zell-Zell-Erkennung findet überall statt, zum Beispiel in der Embryogenese. Unser Überleben hängt auch entscheidend davon ab, dass unser Immunsystem funktioniert und fremde Eindringlinge erkannt und bekämpft werden können. Es wird uns teilweise von unseren Eltern vererbt, kann sich aber auch selbst durch äußere Einflüsse, auf die der Körper dann reagieren kann, selbst trainieren.
Wie sind Sie bei der Analyse des Aggregationsfaktors vorgegangen?
Dario Anselmetti: Die Proteomik, also die Analyse aller vorhandenen Proteine, war entscheidend, um herauszufinden, welche Proteine tatsächlich Teil des AF sind. Wir haben eine Massenspektrometrie-Analyse durchgeführt, um die Proteinzusammensetzung in verschiedenen AF-Proben zu bestimmen. Danach haben wir diese experimentellen Daten mit unseren computergesteuerten AlphaFold-Simulationsanalysen abgeglichen, um zu sehen, ob die vorhergesagten Strukturen auch in den realen AF-Proteinen vorkommen. Die AlphaFold-Technologie nutzt künstliche Intelligenz, um aus der Aminosäuresequenz eines Proteins dessen dreidimensionale Struktur vorherzusagen, und wurde 2024 mit dem Nobelpreis für Chemie ausgezeichnet. Sie analysiert dabei bekannte Proteinstrukturen und sucht nach Mustern, die auf eine bestimmte Faltung hindeuten.
In Ihrer jahrzehntelangen Forschung haben sich die Methoden und Systeme weiterentwickelt. Wie fühlt es sich an, so lange zu einem Thema zu forschen?
Dario Anselmetti: Man merkt natürlich, wie alt man mittlerweile ist (lacht). Aber es ist auch unglaublich befriedigend. Besonders, weil wir mit komplexen, unbekannten Molekülen gearbeitet haben, statt den schnelleren Weg mit einfacheren, bekannten Molekülen zu gehen. Die interdisziplinäre Zusammenarbeit mit Biolog*innen, Mediziner*innenn und Physiker*innen und die Untersuchung des gleichen wissenschaftlichen Themas aus unterschiedlichen Perspektiven, hat das Projekt enorm bereichert. Es ist spannend, die Geschichte unserer Entdeckungen zu erzählen, auch wenn sie viele Sackgassen und Rückschläge umfasst – wie Forschung halt so ist. Besonders wertvoll ist nicht nur, dass dieses Thema mich seit über 30 Jahren begleitet, sondern auch von der Natur und ihren evolutionären Anpassungsstrategien lernen, was zu vielen neuen biomedizinischen Erkenntnissen führt – ein echtes Beispiel für nachhaltige Forschung.

© James M. Davidson/stock.adobe.com