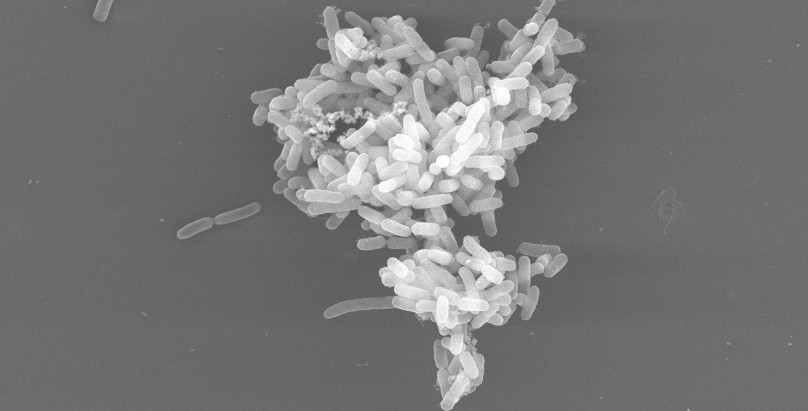
Der sogenannte altruistische Selbstmord von Bakterienzellen ist bislang wenig erforscht. In einem neuen Forschungsprojekt der Universität Osnabrück mit der Universität Bielefeld sollen nun die Hintergründe dieser Verhaltensweisen näher erforscht werden. Die Deutsche Forschungsgemeinschaft (DFG) stellt beiden Universitäten hierfür insgesamt rund 500.000 Euro zur Verfügung.
Bakterien kommen oft in an Oberflächen anhaftenden oder schwimmenden multizellulären Gruppen vor. Diese Gemeinschaften zeigen häufig Verhaltensweisen, die für die Gruppe von Vorteil, für die betreffende Einzelzelle jedoch kostspielig sind. „Ein Beispiel hierfür ist der altruistische Selbstmord von Bakterienzellen. Deren Tod könnte anderen Zellen des Clusters nützen – zum Beispiel, indem genetisch verwandte Zellen mit Nährstoffen versorgt werden oder sich das Cluster dadurch besser verbreiten kann“ erklärt der Osnabrücker Biologe Professor Dr. Christian Kost.
Programmierter Zelltod unter der Lupe
Obwohl mehrere Gene identifiziert wurden, die einen programmierten Zelltod verursachen können, so sind die evolutionären Bedingungen, die solche Verhaltensweisen begünstigen, nur unzureichend verstanden. „Bisher können wir Bakteriengruppen mit Einzelzellauflösung nicht untersuchen. Momentan fehlt uns dazu noch die Techniken mit der notwendigen Auflösung. Dies ist jedoch zwingend erforderlich, um die ökologischen Folgen der Zelllyse im Kontext vielzelliger Bakterienaggregate besser verstehen zu können“, ergänzt sein Bielefelder Kollege Professor Dr. Alexander Grünberger. Ziel dieses Projekt ist es, diese Lücke zu füllen.
Wie Zusammenarbeit langfristig entsteht
Konkret werden hierzu Populationen des Bakteriums Escherichia coli als Modellsystem verwenden. Diese bestehen aus zwei auxotrophen Stämmen des Bakteriums Escherichia coli, die nur wachsen können, wenn sie zwei verschiedene essentielle Aminosäuren miteinander austauschen. Im Laufe eines Koevolutionsexperimentes wurden beide Stämme kooperativer, was sich in einer drastisch erhöhten Aminosäureproduktion relativ zum Ausgangsstamm zeigte. Die Evolution der wechselseitigen Zusammenarbeit konnte auf die Bildung mehrzelliger Cluster zurückgeführt werden, welche kooperative Mutanten in ihrem Wachstum begünstigten.
„Unser Projekt zielt darauf ab, die molekularen Ursachen des programmierten Zelltods zu identifizieren und die evolutionären Konsequenzen für mehrzellige Cluster zu bestimmen. Zu diesem Zweck werden wir Analysen von Mutanten mit sorgfältig konzipierten Kokulturexperimenten kombinieren“, berichtet Prof. Kost.
Darüber hinaus soll eine neuartige mikrofluidische Plattform entwickelt werden, die es ermöglicht, dreidimensionale multizelluläre Cluster mit Einzelzellauflösung unter definierten Umweltbedingungen zu kultivieren, zu beobachten und zu analysieren. Prof. Grünberger abschließend: „Durch Identifizierung der molekularen Ursachen und öko-evolutionären Konsequenzen des programmierten Zelltods von Bakterien wird unser Projekt wesentlich zu einem besseren Verständnis der Entstehung dieses auf Gruppenebene weit verbreiteten Verhaltens beitragen. Die dabei gewonnen Erkenntnisse werden einen wichtigen Beitrag dazu leisten, dass Bakterien nicht mehr als einzellig und einfach strukturiert, sondern als multizelluläre und hochkomplexen Organismen wahrgenommen werden.